耳聋是一种常见的感官缺陷疾病之一,位居我国各类残疾之首,其中60%以上的耳聋由遗传因素引起,遗传性耳聋在新生儿中发生率约为1/500。目前临床上对于遗传性耳聋的治疗,主要是通过植入人工耳蜗、佩戴助听器以及化学药物治疗,但这些都不能从根本上治疗耳聋。近年来,基因治疗药物为常规方法无法治疗的疾病提供了希望,截止2024年9月,全球获批上市的基因治疗药物共54款(不含DNA和mRNA疫苗),以病毒为载体的基因疗法就有16款。AAV载体凭借其高安全性,低免疫原性等优势,可以安全地转导中枢神经系统和感官系统,并在多种疾病的基因治疗中显示出巨大潜力,这为遗传性耳聋的治愈带来了新的希望。目前,已有多项研究表明,使用AAV作为基因治疗载体可以部分或完全恢复遗传性耳聋小鼠模型的听力。
01 耳朵结构
耳朵分为外耳、中耳和内耳三部分,其中外耳和中耳传导声波,内耳是听觉和位觉感受器。在结构上,外耳包括耳廓和外耳道,中耳由鼓膜、鼓室及听骨链组成,内耳位于颞骨岩部内,包括半规管、前庭和耳蜗(cochlea)。值得注意的是,大多数引起耳聋的基因主要在耳蜗内的细胞中表达,因此,AAV介导的针对听力损失的基因疗法一般都集中于靶向耳蜗结构。
哺乳动物的耳蜗内含有两种类型的毛细胞(Hair Cells, HCs):内毛细胞(IHCs)和外毛细胞(OHCs),这两种毛细胞对听觉信号的检测和处理至关重要,成熟的哺乳动物毛细胞不能再生,因此这些细胞一旦发生损伤,其退化过程往往是不可逆的。支持细胞(Supporting cells, SCs)围绕在毛细胞外周,对耳蜗内稳态十分重要,引起先天性耳聋的GJB2基因即在支持细胞中表达。螺旋神经节神经元(Spiral Ganglion Neurons, SGNs)是听觉系统的一级神经元,在听觉传导过程中起重要作用。
此外,由毛细胞、支持细胞及其它附属结构构成了Corti器(柯蒂氏器),Corti器周围是充满外淋巴管的前庭阶(Scala vestibuli)、鼓阶(Scala tympani)以及充满内淋巴管的蜗管(Scala media)。
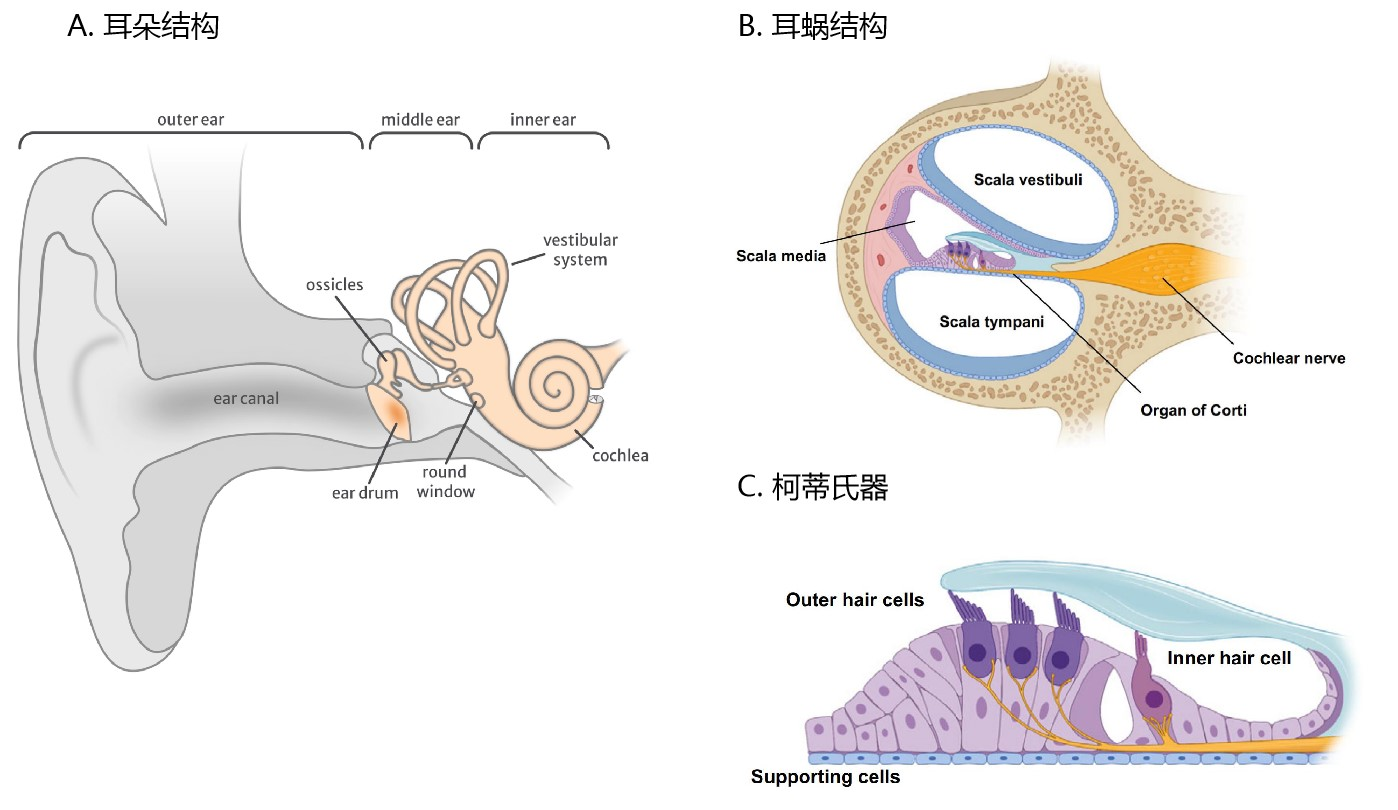
图1. 耳朵结构分析
(https://www.audiocure.com/inner-ear-disorders/)
(Peters CW, et al. Trends Pharmacol Sci. 2021)
02 AAV靶向内耳策略
1
1)启动子选择
· 组成型启动子
CMV和CBA已被证明可驱动耳蜗毛细胞、支持细胞等多种细胞类型中的转基因表达,Pgk1(磷酸甘油酸激酶1)启动子则可驱动外源基因在支持细胞中表达。
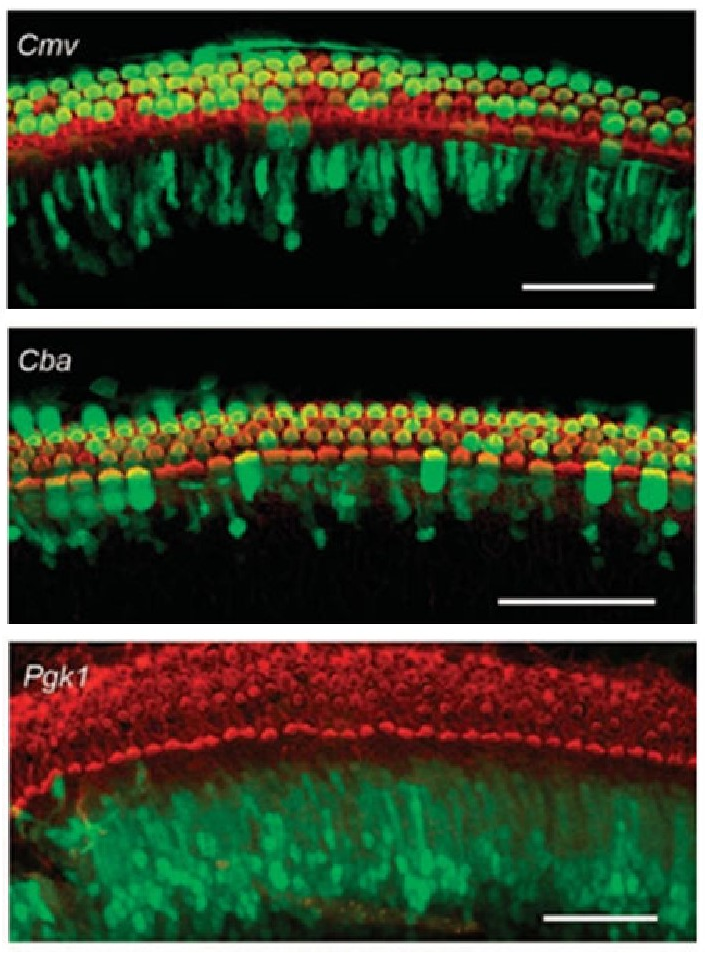

图2. CMV、CBA和Pgk1启动子驱动外源基因在离体培养小鼠耳蜗细胞中的表达
(Askew C, et al.Sci Transl Med.2015)
· 特异性启动子
Syn1(突触素1)启动子可驱动外源基因在耳蜗螺旋神经节神经元中的有效转导,Myo7a(人肌球蛋白ⅦA)、Pou4f3(POU结构域第4类转录因子3)和Slc26a5(溶质载剂家族26成员5)是转导毛细胞的可选启动子,使用时应考虑AAV的包装容量。
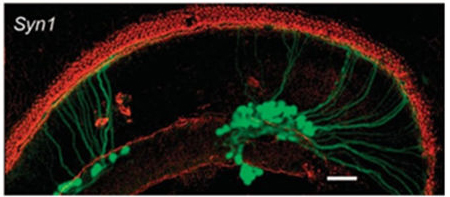

图3. Syn1启动子驱动外源基因在离体培养小鼠耳蜗耳蜗螺旋神经节神经元中的表达
(Askew C, et al.Sci Transl Med.2015)
2)注射方式选择
应用于内耳的注射方式主要有:圆窗膜(RWM)注射、耳蜗造口术(Cochleostomy)、后半规管(PSCC)注射及胞囊(Utricle)注射。
·圆窗膜(RWM)注射是新生小鼠以及非人灵长类动物(NHPs)中常用的方法,载体可传送至耳蜗鼓阶的外淋巴。该注射方法对内耳外毛细胞转导率相对有限。
·后半规管(PSCC)注射能使病毒载体有效地感染新生小鼠耳蜗和前庭器官的细胞。该方法同样具有侵入性,可能会有损伤毛细胞的风险。
·耳蜗造口术(Cochleostomy)涉及穿透侧壁,一般在成年受试者耳蜗骨钙化后使用,载体可输送至蜗管的内淋巴。该方法具有侵入性,可能会有损伤毛细胞的风险,造成听力损害。
·胞囊注射可能会使载体传递至内淋巴,已被证明可在耳蜗中实现多种AAV血清型的高水平表达,研究表明在相同血清型、启动子、病毒滴度及注射体积条件下,胞囊注射方法在新生小鼠内耳IHCs和OHCs中的转导率均略高于RWM注射法。
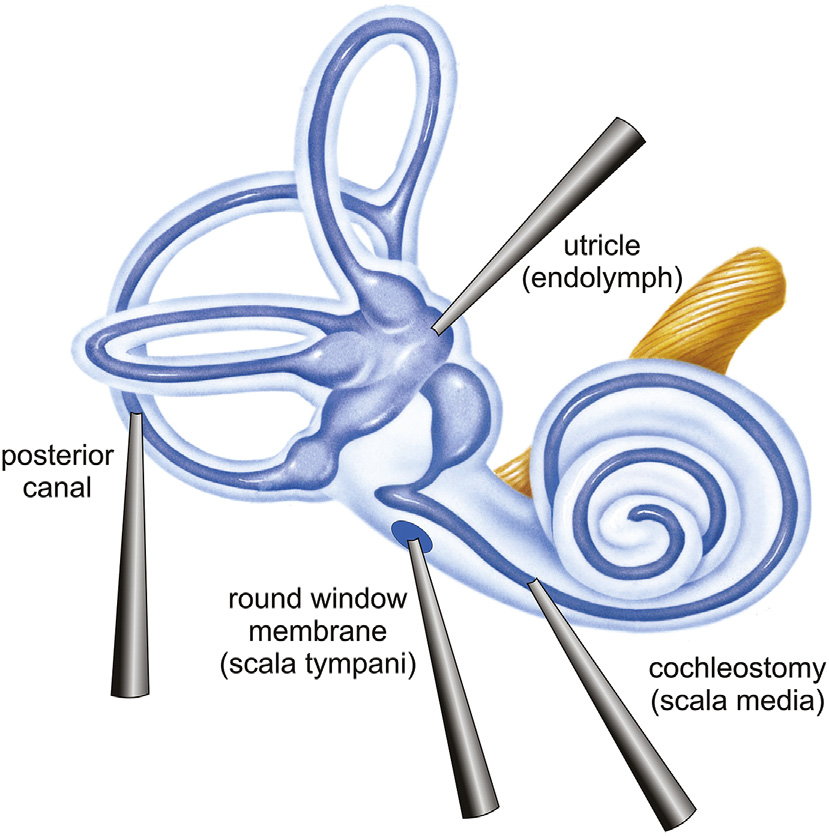
图4. 耳蜗内的不同注射途径
(Maguire CA, et al. Hear Res. 2020)
下面介绍圆窗膜(RWM)注射、后半规管(PSCC)注射和耳蜗造口术注射方式的操作步骤:
1、圆窗膜(RWM)注射
1) 腹腔注射氯胺酮(100mg /kg)、甲苯噻嗪(10mg /kg)和乙酰丙嗪(2mg /kg)混合物麻醉小鼠,确保小鼠对疼痛刺激(如脚趾夹)无反应后,才能开始手术准备;
2) 在小鼠眼睛上涂抹保护性的药膏,使其在麻醉期间保持眼睛湿润,并抑制眨眼反射;
3) 在整个过程中,将小鼠的颈部伸展放在加热垫上,直到小鼠完全清醒,以防止麻醉后体温过低;
4) 用剃刀刮掉小鼠耳后的毛发,并用70%乙醇和聚维酮碘消毒;
5) 在外耳下方做一个切口,将软组织推开,露出鼓室大疱;
6) 用25G针在鼓室大疱上穿孔,然后充分扩大以可见镫骨动脉(SA)和圆窗膜(RWM);
7) 用硼硅酸盐毛细管移液管在RWM中心轻轻穿刺,观察液体通过RWM的流出情况(耳蜗流出的液体用无菌滤纸干燥);
8) 在射流稳定后(5-10 min),将0.6~2μL的AAV载体通过RWM注射到耳蜗鼓阶;
9) 拔出移液管后,用一小块肌肉组织迅速密封RW龛,并在肌肉上滴一小滴组织胶固定,以避免耳蜗周围淋巴液通过RWM渗漏;
10) 注射完毕后,用脂肪组织覆盖大疱孔,将耳后肌和脂肪组织恢复正常位置,用6-0或更小的可吸收铬线分层缝合伤口,并作消毒处理;
11) 把小鼠放在一个温暖干净的笼子里观察看护,待其完全恢复;
12) 术后皮下注射卡洛芬(2 mg/kg)进行镇痛,此后每24小时注射一次,持续3天,以控制炎症和疼痛。每天监测动物是否有痛苦、体重异常减轻、疼痛或感染的迹象。一般情况下,所有小鼠在手术后第三天应能正常活动。
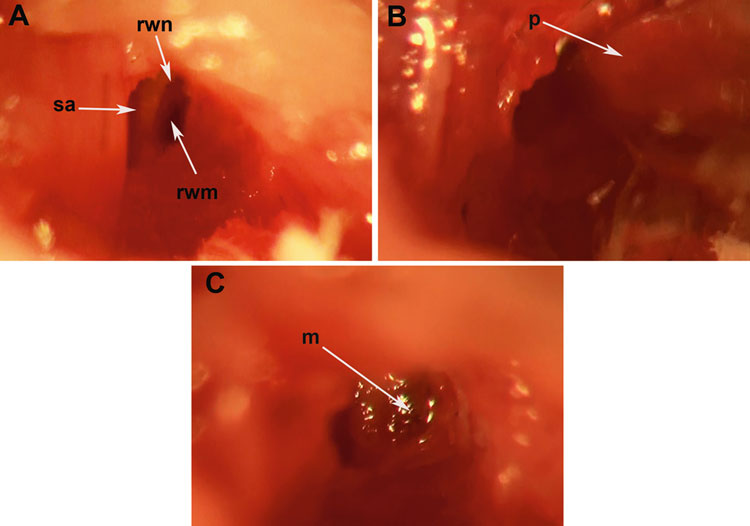
图5. 圆窗膜(RWM)注射
(Akil O, et al.Methods Mol Biol. 2019)
2、后半规管(PSCC)注射
1) 通过腹腔注射氯胺酮(100 mg/kg)和甲苯噻嗪(20 mg/kg)麻醉小鼠;
2) 用剃刀刮掉小鼠左耳后的毛发,并用10%聚维酮碘消毒;
3) 对耳后皮肤做一个15mm的切口,解剖暴露面神经及胸锁乳突肌后,切除近端部分肌肉;
4) 使用4-0 vicryl缝合线将覆盖颞骨的肌肉分离并向背侧收回,露出后半规管的骨壁,清晰可见为一条深色条纹;
5) 使用26号皮下注射针在后半规管附近扎一个小孔,等待5min,待外淋巴液渗漏减轻后,将聚酰亚胺管的尖端以贴近壶腹部的方式插入后半规管中;
6) 聚酰亚胺管与小孔之间的缝隙用肌肉碎片和氰基丙烯酸酯胶密封,通过无液体泄漏直观评估密封的严密性;
7) 将250 nL的病毒悬液以100 nL/min的速度在2.5 min内注入后半规管中,注射后将试管留在后半规管中静置5min;
8) 取出管子后,用小块肌肉堵住小孔,并涂上氰基丙烯酸酯胶水,最后用5-0尼龙缝合线缝合伤口;
9) 把小鼠放在一个温暖干净的笼子里,待其完全恢复。
图6. 后半规管(PSCC)注射
(Suzuki J, et al. Sci Rep. 2017)
3、耳蜗造口术
1) 通过腹腔注射甲苯噻嗪(10mg/kg)和氯胺酮(100mg/kg)麻醉小鼠;
2) 对小鼠右耳后区域进行剃毛,并用10%聚维酮碘消毒;
3) 在手术显微镜下,于耳后做一个长约10 mm的切口,提取右侧耳廓及胸锁乳突肌,暴露位于颞骨边缘的PSCC;
4) 用波恩微型探针在PSCC上钻一个小孔,等待几分钟,直到没有明显的外淋巴液流出;
5) 将聚酰亚胺管的尖端插入PSCC中,并使用组织粘合剂密封小孔,确保没有外淋巴液流出;
6) 利用MICRO4微量注射控制器控制聚酰亚胺管进行病毒注射,速率179nL/min,每次注射病毒总体积为1 µL或2 µL,时间控制在5-10min;
7) 注射后切断聚酰亚胺管,留下约5mm与PSCC相连。用组织粘合剂密封残留的管孔,然后用5-0 Ethilon线缝合皮肤;
8) 把小鼠放在一个温暖干净的笼子里观察看护,待其完全恢复。
以上是关于AAV在内耳应用中的启动子和注射方式的选择策略,下期我们将继续分享内耳应用中AAV血清型和载体的选择,敬请期待~
